
Ένας ακριβής δείκτης της Γήρανσης και της Νόσου
Η μείωση του μήκους των τελομερών είναι ο πρωταρχικός λόγος γήρανσης και της εμφάνισης νόσων που συνδέονται με το γήρας όπως ο καρκίνος, τα αυτοάνοσα και τα καρδιαγγειακά νοσήματα. Η Ανάλυση του Μήκους των Τελομερών είναι ένας ακριβής δείκτης προσδιορισμού της βιολογικής σε σχέση με την χρονολογική ηλικία και είναι μια σημαντική ανακάλυψη της ιατρικής στην αντιμετώπιση των χρόνιων νοσημάτων και στην αύξηση της διάρκειας ζωής.
Τελομερή DΝΑ και Χρωμοσώματα
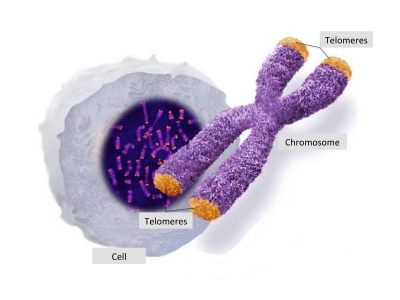
 Το DNA είναι ο γενετικός κώδικας που περιέχει τις πληροφορίες για τη κατασκευή και την λειτουργία του ανθρώπινου σώματος. Μπορούμε να το παρομοιάσουμε σαν το σκληρό δίσκο σε έναν υπολογιστή που έχει αποθηκευμένα όλα τα προγράμματα που λειτουργούν μέσα σε αυτόν. Το DNA μας είναι διαμορφωμένο σε ένα μακρύ νήμα διπλής έλικας τυλιγμένο στη μορφή των χρωμοσωμάτων. Σαν ένα κουβάρι που αντί να είναι στρογγυλό έχει διπλωθεί έτσι ώστε να σχηματίζει ένα “Χ”. Υπάρχουν 23 ζεύγη χρωμοσωμάτων στα ανθρώπινα κύτταρα.
Το DNA είναι ο γενετικός κώδικας που περιέχει τις πληροφορίες για τη κατασκευή και την λειτουργία του ανθρώπινου σώματος. Μπορούμε να το παρομοιάσουμε σαν το σκληρό δίσκο σε έναν υπολογιστή που έχει αποθηκευμένα όλα τα προγράμματα που λειτουργούν μέσα σε αυτόν. Το DNA μας είναι διαμορφωμένο σε ένα μακρύ νήμα διπλής έλικας τυλιγμένο στη μορφή των χρωμοσωμάτων. Σαν ένα κουβάρι που αντί να είναι στρογγυλό έχει διπλωθεί έτσι ώστε να σχηματίζει ένα “Χ”. Υπάρχουν 23 ζεύγη χρωμοσωμάτων στα ανθρώπινα κύτταρα.
Τα ακραία τμήματα των χρωμοσωμάτων (βλέπε τις πορτοκαλί άκρες των χρωμοσωμάτων στην παραπάνω εικόνα) ονομάζονται τελομερή. Το όνομά τους προέρχεται από τις ελληνικές λέξεις τέλος- και -μέρος. Τα τελομερή χρησιμεύουν για την προστασία του DNA. Συγκρίνονται συχνά με το πλαστικό προστατευτικό κάλυμμα που βρίσκεται στην άκρη από τα κορδόνια των παπουτσιών που προστατεύουν το κορδόνι από το να ξεφτίσει στην άκρη. Κατά τον ίδιο τρόπο, τα τελομερή παίζουν σημαντικό ρόλο στην προστασία του DNA.
Το μήκος των τελομερών αλλάζει κατά τη διάρκεια της ζωής μας._svg.jpg) Κάθε φορά που τα κύτταρα μας διπλασιάζονται ένα μικρό τμήμα του τελικού DNA δεν αντιγράφεται. Το τμήμα που δεν αντιγράφεται αφορά τα τελομερή και έτσι αντί να χάνεται ένα κομμάτι του DNA μας χάνεται ένα τμήμα των τελομερών με αποτέλεσμα αυτά να συρρικνώνονται κατά τη διάρκεια της ζωής μας.
Κάθε φορά που τα κύτταρα μας διπλασιάζονται ένα μικρό τμήμα του τελικού DNA δεν αντιγράφεται. Το τμήμα που δεν αντιγράφεται αφορά τα τελομερή και έτσι αντί να χάνεται ένα κομμάτι του DNA μας χάνεται ένα τμήμα των τελομερών με αποτέλεσμα αυτά να συρρικνώνονται κατά τη διάρκεια της ζωής μας.
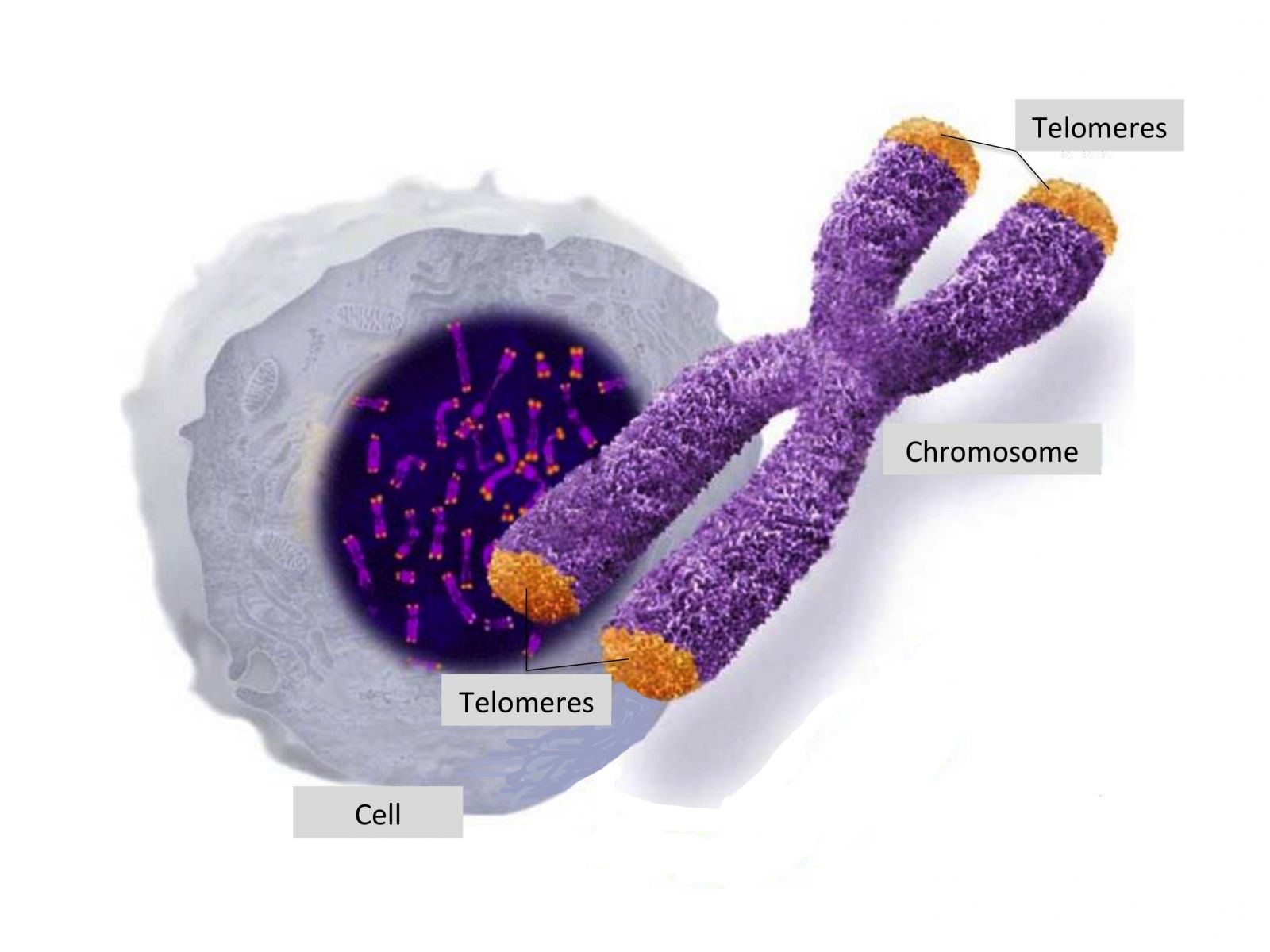
Τα ανθρώπινα κύτταρα ξεκινούν κατά τη σύλληψη με ένα μέσο μήκος τελομερών 15.000 βάσεων (μονάδα μέτρησης του μήκους των τελομερών, base pairs). Κατά τη διάρκεια της εμβρυϊκής περιόδου και λόγω του υψηλού ρυθμού κυτταρικής αντιγραφής που υπάρχει κατά την ανάπτυξη του εμβρύου, χάνεται το ένα τρίτο του ολικού μήκους των τελομερών.
Έτσι κατά τη γέννηση το μέσο μήκος των τελομερών είναι 10.000 βάσεις. Στην ηλικία των 20 ετών το μέσο μήκος των τελομερών μας είναι περίπου 8.000 βάσεις. Συνεχίζουμε να χάνουμε 35-150 βάσεις ανά έτος μέχρι να φτάσουμε σε ένα επίπεδο μικρότερο των 4500 βάσεων, όπου το DNA γίνεται ιδιαίτερα ασταθές και οι πιθανότητες για την εμφάνιση σοβαρών προβλημάτων υγείας και θανάτου αυξάνονται εκθετικά.
Πέρα από την απόλυτη  τιμή του μήκους των τελομερών, ο πιο σημαντικός παράγοντας για την υγεία μας είναι ο ρυθμός συρρίκνωσης τους. Ένα άτομο που χάνει 35 βάσεις ετησίως για παράδειγμα, γερνά με ένα ρυθμό που είναι πέντε φορές πιο αργός σε σχέση με κάποιον που χάνει 150 βάσεις στο ίδιο χρονικό διάστημα. Είναι επίσης σημαντικό σε αυτό το σημείο να αναφέρουμε ότι τα ανθρώπινα κύτταρα διαθέτουν εγγενείς μηχανισμούς που διορθώνουν και μπορούν ακόμη και επιμηκύνουν εκ νέου τα τελομερή τους.
τιμή του μήκους των τελομερών, ο πιο σημαντικός παράγοντας για την υγεία μας είναι ο ρυθμός συρρίκνωσης τους. Ένα άτομο που χάνει 35 βάσεις ετησίως για παράδειγμα, γερνά με ένα ρυθμό που είναι πέντε φορές πιο αργός σε σχέση με κάποιον που χάνει 150 βάσεις στο ίδιο χρονικό διάστημα. Είναι επίσης σημαντικό σε αυτό το σημείο να αναφέρουμε ότι τα ανθρώπινα κύτταρα διαθέτουν εγγενείς μηχανισμούς που διορθώνουν και μπορούν ακόμη και επιμηκύνουν εκ νέου τα τελομερή τους.
Πολλαπλοί παράγοντες συμμετέχουν στην ενεργοποίηση αυτών των μηχανισμών διόρθωσης και επιμηκύνσεις των τελομερών. Συγκεκριμένες βιταμίνες, αντιοξειδωτικά, η διατροφή, τα ωμέγα 3 λιπαρά οξέα, η άσκηση, φυσικά αλλά και φαρμακευτικά σκευάσματα έχουν συσχετιστεί με μεγαλύτερο μέσο μήκος αλλά και την εκ νέου επιμήκυνση των τελομερών.
Tελομερή, Υγεία και Ασθένειες που συνδέονται με τη Γήρανση
Εάν δεν υπήρχαν τα τελομερή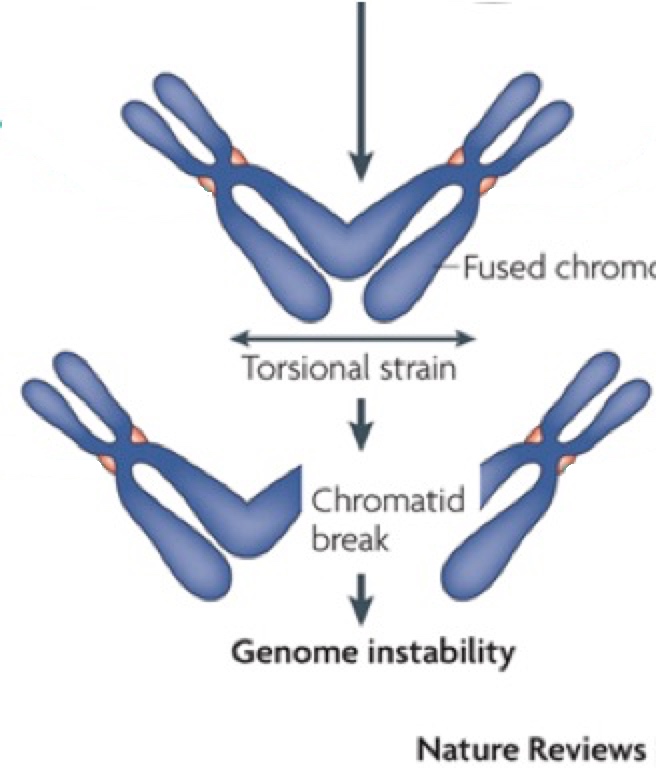 ή δεν το μήκος τους δεν ήταν επαρκές, τα άκρα διαφορετικών χρωμοσωμάτων θα ενώνονταν μεταξύ τους προκαλώντας κυτταρικές δυσλειτουργίες ή και κυτταρικό θάνατο. Πράγματι, όταν τα τελομερή είναι πολύ κοντά τα άκρα των χρωμοσωμάτων ενώνονται μεταξύ τους και αυτό έχει εντοπιστεί ως το πρώτο βήμα της καρκινογένεσης.
ή δεν το μήκος τους δεν ήταν επαρκές, τα άκρα διαφορετικών χρωμοσωμάτων θα ενώνονταν μεταξύ τους προκαλώντας κυτταρικές δυσλειτουργίες ή και κυτταρικό θάνατο. Πράγματι, όταν τα τελομερή είναι πολύ κοντά τα άκρα των χρωμοσωμάτων ενώνονται μεταξύ τους και αυτό έχει εντοπιστεί ως το πρώτο βήμα της καρκινογένεσης.
Η συρρίκνωση των τελομερών δεν είναι όμως απλά ένα σύμπτωμα του γήρατος αλλά ο λόγος για τον οποίο γερνάμε. Κατά τη διάρκεια της ζωής μας, τα τελομερή μας μικραίνουν σταδιακά και αυτός είναι ο βασικός λόγος του γήρατος στον άνθρωπο.
Τα κύτταρα μας διαιρούνται και σχηματίζουν νέα κύτταρα κατά τη διάρκεια της ζωής μας αντικαθιστώντας παλαιότερα κύτταρα που έχουν υποστεί βλάβες. Με κάθε κυτταρική διαίρεση όμως ένα τμήμα των τελομερών μας δεν αντιγράφεται και αυτό προκαλεί τη σταδιακή τους συρρίκνωση. Όσο πιο κοντά είναι τα τελομερή τόσο πιο ασταθές γίνεται το DNA και τόσο αυξάνει η πιθανότητα εμφάνισης νόσου.
Όσο πιο κοντά είναι τα τελομερή μας τόσο μεγαλύτερη είναι και η βιολογική μας ηλικία. Ενώ ισχύει και το αντίθετο. Όσο μακρύτερα είναι τα τελομερή μας τόσο μικρότερη είναι και η βιολογική μας ηλικία και τόσο καλύτερη η υγεία μας.
Το 2009 το Νόμπελ Ιατρικής απονεμήθηκε σε 3 επιστήμονες - E. Blackburn, C. Greider, J. Szosak - για τις ανακαλύψεις τους στη βιολογία των τελομερών και στους μηχανισμούς γήρανσης του ανθρώπινου οργανισμού. Παλαιότερα και πριν την ανακάλυψη των τελομερών, πιστεύαμε ότι η γήρανση προκύπτει με την πάροδο του χρόνου μέσω της συσσώρευσης βλαβών σε επίπεδο κυττάρων και οργάνων. Θεωρούσαμε ότι οι βλάβες συσσωρεύονται και το σώμα μας φθείρεται μέσα από τη χρήση κατά τον ίδιο τρόπο που φθείρεται και μια μηχανή. Μέσα όμως από τις ανακαλύψεις της βιολογίας των τελομερών αποκαλύφθηκε ότι η αλήθεια είναι εντελώς διαφορετική.
Δεν γερνάμε εξαιτίας της φθοράς και της συσσώρευση βλαβών σε κυτταρικό επίπεδο, αλλά κυρίως μέσω του μηχανισμού συρρίκνωσης των τελομερών. Οι συσσωρευμένες βιολογικές βλάβες αναγκάζουν όμως τα κύτταρα μας να διαιρούνται με υψηλότερο ρυθμό, πράγμα που συρρικνώνει ταχύτερα τα τελομερή μας με αποτέλεσμα να γερνάμε και να πεθάνουμε νωρίτερα από την μέγιστη γενετικά προκαθορισμένη διάρκεια ζωής. Η φθορά δεν είναι λοιπόν η αιτία της γήρανσης, αλλά ένας παράγοντας που την επιταχύνει. Η δύο αυτοί μηχανισμοί μπορεί να φαίνονται παρόμοιοι μεταξύ τους η διαφορά όμως είναι τεράστια στον τρόπο που μας επιτρέπουν τελικά να επηρεάσουμε τη μακροζωία και την υγεία μας.
Τα κύτταρά μας έχουν στη διάθεση τους ένα περιορισμένο αριθμό διαιρέσεων κατά τη διάρκεια της ζωής μας. Ο αριθμός αυτός είναι περίπου 50 κυτταρικές διαιρέσεις και ρυθμίζεται μέσα από το μήκος των τελομερών. Έτσι γεννιόμαστε με έναν πεπερασμένο αριθμό κυτταρικών διαιρέσεων στη διάθεσή μας και ο τρόπο ζωής μας καθορίζει πόσο θα μας διαρκέσουν οι κυτταρικές διαιρέσεις που έχουμε στη διάθεση μας.
Ενέργειες και παράγοντες που βλάπτουν τα κύτταρα μας, όπως το κάπνισμα, το να μην κοιμόμαστε αρκετά, οι κακές διατροφικές επιλογές, να έχουμε ελλείψεις σε βιταμίνες και θρεπτικά συστατικά, η υπερβολική κατανάλωση αλκοόλ, η χρήση ναρκωτικών ουσιών, η παχυσαρκία, η έλλειψη άσκησης, το άγχος, η μη επαρκής κατανάλωση νερού και η έκθεση σε τοξίνες θα αναγκάσουν τα κύτταρά μας να διαιρούνται με ταχύτερο ρυθμό, προκειμένου να επισκευάσουν τους ιστούς που υπόκεινται σε βλάβη και αυξάνουν κατά συνέπεια την ταχύτητα που γερνάμε. Πράγματι, όλοι οι παραπάνω παράγοντες συσχετίζονται με κοντύτερα τελομερή, αυξημένη συχνότητα εμφάνισης νόσου και πρόωρο θανάτο.
 ταχύτερα διαιρούνται τα κύτταρά μας τόσο ταχύτερα συρρικνώνονται και τα τελομερή μας. Περισσότερες οι βλάβες σε κυτταρικό επίπεδο αντιστοιχούν σε μεγαλύτερο αριθμό κυτταρικών διαιρέσεων για την διόρθωση των ιστών.
ταχύτερα διαιρούνται τα κύτταρά μας τόσο ταχύτερα συρρικνώνονται και τα τελομερή μας. Περισσότερες οι βλάβες σε κυτταρικό επίπεδο αντιστοιχούν σε μεγαλύτερο αριθμό κυτταρικών διαιρέσεων για την διόρθωση των ιστών. 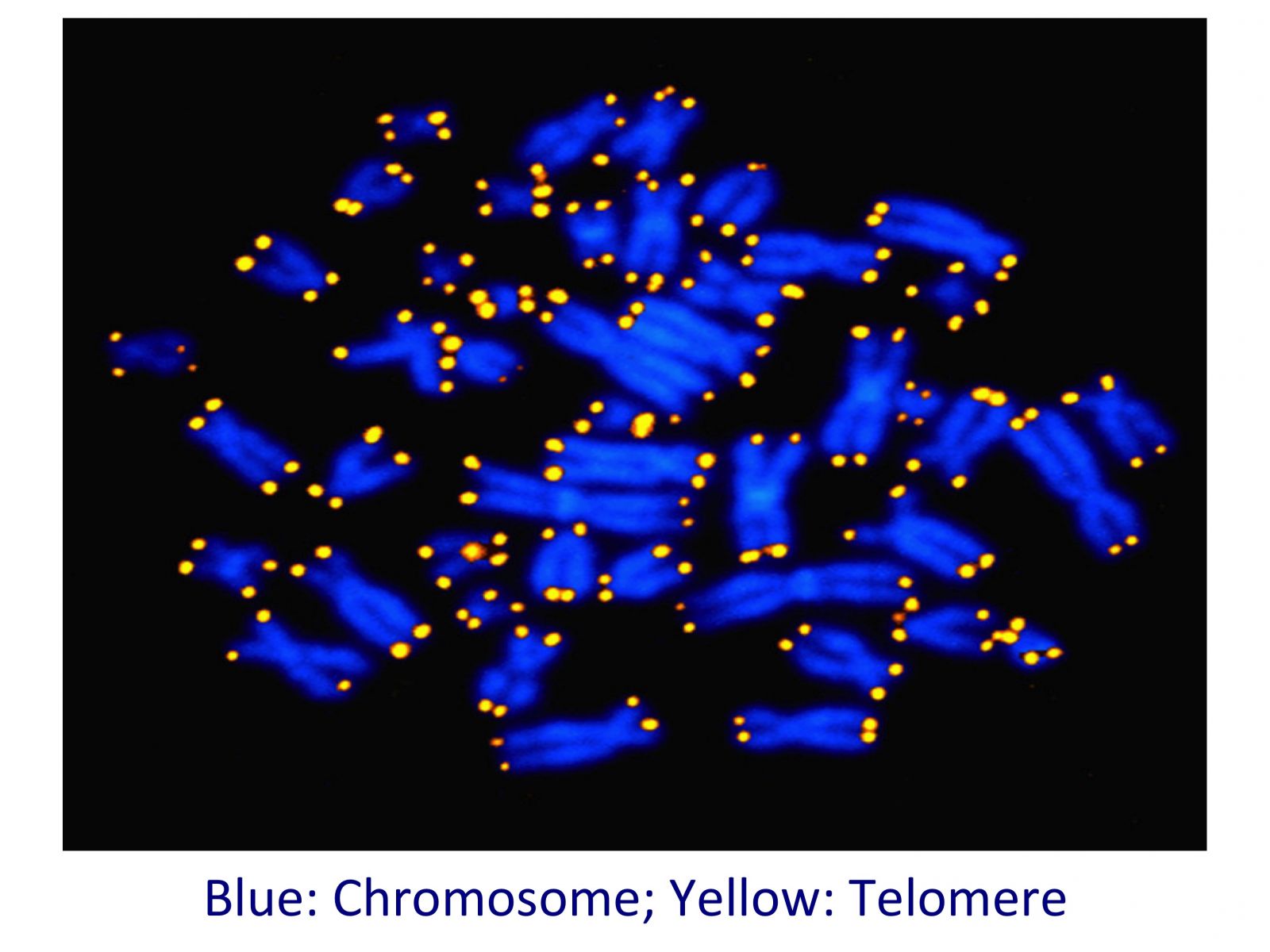 μπορεί να έχει ένα καλό μέσο μήκος τελομερών, αλλά και ένα υψηλό ποσοστό κοντών τελομερών, πράγμα που δεν θα φανεί σε μια μέτρηση που αφορά στο μέσο μήκος. Το DNA του θα μπορούσε στη συνέχεια να είναι ασταθές, λόγω της ύπαρξης αυξημένου ποσοστού κοντών τελομερών χωρίς αυτό να φαίνεται σε μια τέτοια εξέταση.
μπορεί να έχει ένα καλό μέσο μήκος τελομερών, αλλά και ένα υψηλό ποσοστό κοντών τελομερών, πράγμα που δεν θα φανεί σε μια μέτρηση που αφορά στο μέσο μήκος. Το DNA του θα μπορούσε στη συνέχεια να είναι ασταθές, λόγω της ύπαρξης αυξημένου ποσοστού κοντών τελομερών χωρίς αυτό να φαίνεται σε μια τέτοια εξέταση.
Βιβλιογραφικές Αναφορές